①钠、氢气都能在氯气中燃烧生成白色烟雾
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯气的水溶液,它能使干燥的有色布条褪色
④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
①金属钠、氢气都能在氯气中燃烧,生成白色的烟雾;②铜丝在氯气中燃烧,生成蓝绿色的氯化铜;③液氯就是氯气的水溶液,它能使干燥的有色布条褪色;④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
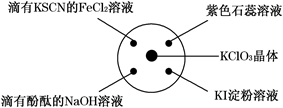
| 选项 | 实验现象 | 结论 |
| A | 滴有 KSCN 的 FeCl2 溶液变红色 | Cl2 具有还原性 |
| B | 滴有酚酞的 NaOH 溶液褪色 | Cl2 具有酸性 |
| C | 淀粉 KI 溶液中变蓝色 | Cl2 具有氧化性 |
| D | 石蕊溶液先变为红色后褪色 | Cl2 具有漂白性 |

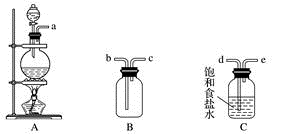
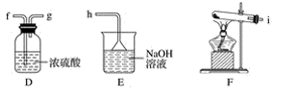
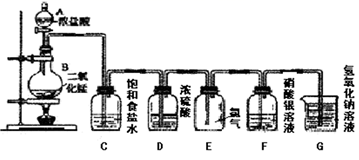
①用不到的仪器是(填大写字母)
②将各仪器按先后顺序连接起来,应该是:(用导管口处的字母表示)。
③浓盐酸与二氧化锰反应的离子方程式
④ C的作用,D的作用,E中倒置漏斗的作用是

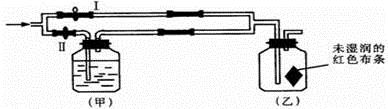
① 通少量Cl2时,G中的现象是,原因是(用化学方程式表示)
② H中的现象是。
③ 烧杯中NaOH溶液的作用是

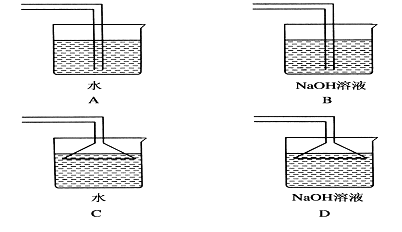
①NaOH溶液 ②饱和食盐水 ③AgNO3溶液 ④浓H2SO4

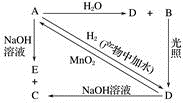
①混合物加水得无色透明溶液;
②向上述溶液中滴加BaCl2溶液,有白色沉淀生成,将该沉淀滤出,并将滤液分成两份;
③上述白色沉淀可完全溶于稀盐酸;
④往一份滤液中滴加氯水并加入CCl4 , 振荡后静置CCl4层呈无色(氯水能将I-氧化为I2);
⑤往另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
由此可推断出: