|
实验 |
装置 |
试剂a |
现象 |
|
① |
|
Ca(OH)2溶液(含酚酞) |
溶液褪色,产生白色沉淀 |
|
② |
少量NaHCO3溶液 |
产生气泡 |
|
|
③ |
酸性KMnO4溶液 |
紫色溶液褪色 |
|
|
④ |
C2H5OH和浓硫酸 |
加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式错误的是( )
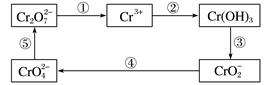
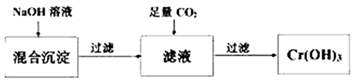
写出从该沉淀物中分离出Cr(OH)3的离子方程式、。
① +6I-+14H+=3I2+2Cr3++7H2O
②2 +I2=
+2I-
准确称取纯净的K2Cr2O7 0.1225g配成溶液,用上述方法滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为(保留四位有效数字)。

已知: ![]()
![]()
回答下列问题:
a.苯环上只有两个取代基且互为邻位
b.既能发生银镜反应又能发生水解反应
 为主要原料,经最少步骤制备含酰胺键(结构与肽键相同)聚合物的流程。
为主要原料,经最少步骤制备含酰胺键(结构与肽键相同)聚合物的流程。  ……
…… 
已知:Ⅰ.二茂铁熔点是173 ℃,在100℃时开始升华;沸点是249℃。
Ⅱ.制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O。
实验步骤为:
①在三颈烧瓶中加入25 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10 min;
②再从仪器a滴入5.5 mL新蒸馏的环戊二烯(C5H6 , 密度为0.95 g·cm-3),搅拌;
③将6.5 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入仪器c中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
