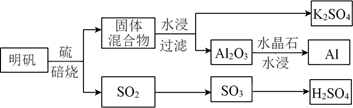
焙烧明矾的化学方程式为。
|
第一电离能 |
离子半径 |
熔点 |
酸性 |
|
OS |
Cl-K+ |
KClAl2O3 |
H2SO4HClO4 |
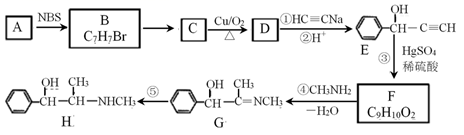
已知:CH3—C≡CH+H2O CH3COCH3
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
某反应的平衡常数表达式K3= ,请写出此反应的热化学方程式,K1、K2、K3之间的关系是。
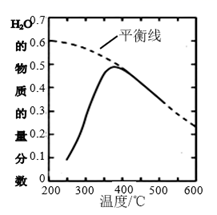
①该反应的平衡常数K随温度降低而(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,达到平衡状态的是。
a.混合气体密度不再改变 b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变 d.n(CO2)∶n(H2)=1:2
③200℃达到平衡时体系的总压强为P,该反应平衡常数Kp的计算表达式为(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

①阳极反应式是。
②结合电极反应式,简述K2CO3溶液的再生原理。
①将20 mL NaOH溶液加入仪器b中,冷水浴冷却,通入Cl2 , 搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。
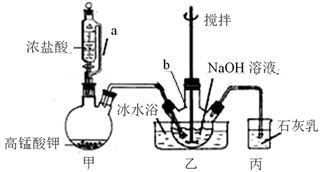
②将所得饱和NaClO倒入烧杯并置于冷水浴中,分几次加入20 g NaOH固体并不断搅拌,过滤,得NaClO强碱性饱和溶液。
甲装置中a管的作用是。
①称取5.05 g Fe(NO3)3·9H2O(相对分子质量为404)固体,在冷水浴中分批加入Ⅰ中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即Na2FeO4)。
②离心分离除去Na2FeO4水解得到的Fe(OH)3胶体,留上层清液(深紫红色)。
③向②的上层清液中缓慢加入KOH饱和溶液50.00mL,冰水浴保持5 min,过滤,得K2FeO4(相对分子质量为198)粗产品。
④将粗产品重结晶,并用异丙醇洗涤,低温烘干,得纯产品2.13 g。
合成Na2FeO4的离子方程式为。