2AlH3(g)=2Al(s)+3H2(g) △H1 H2(g)+ O2(g)=H2O(g) △H2 Al(s)= Al(g) △H3 Al(g) +
O2(g)=
Al2O3(s) △H4

下列分析正确的是( )
a.反应①的化学方程式为HCHO+2Ag2O=CO2↑+ 4Ag↓+H2O
b.理论上吸收的HCHO与消耗的Fe3+的物质的量比为1:4
c.取1m3空气,经上述实验后共得到Fe2+ 1.12 mg,室内甲醛含量达标
①硫元素在元素周期表中的位置是 。
②乙硫醇(CH3CH2SH)是一种含硫有机物,其分子中S-H的极性小于CH3CH2OH分子中O-H的极性,请从原子结构角度解释其原因:。

①上图所涉及的含硫物质中,能使品红溶液褪色的是。
②降解石油(主要成分为CxHy)的过程中,在细菌催化作用下,石油与硫酸盐反应转化为碳酸氢盐,硫酸盐做(填“氧化剂”或“还原剂”)。
③煤炭中的硫化物主要为FeS2(S为-1价)。在潮湿的环境中,FeS2可在氧化亚铁硫杆菌(T.f)的作用下被空气氧化为Fe2(SO4)3 , 该反应的化学方程式为。
Cd+2NiOOH+2H2O 2Ni(OH)2+Cd(OH)2
制造密封式镍镉电池的部分工艺如下:
以硫酸镍(NiSO4)为原料制备Ni(OH)2的主要过程如下图所示。制备过程中,降低Ni(OH)2沉淀速率,可以避免沉淀团聚,提升电池性能。
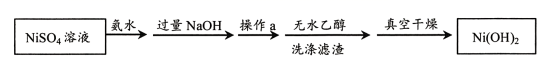
已知:Ni2++6NH3•H2O⇌[Ni(NH3)6]2++6H2O
操作a是 。
①先加氨水的目的是 。
②用化学平衡移动原理分析加入NaOH需过量的原因是。
主要步骤:①将Ni(OH)2和Cd(OH)2固定,中间以隔膜隔开(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
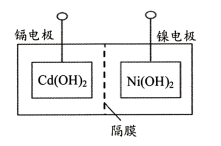
下列对镍镉电池组装和使用的分析正确的是(填字母序号)。
a.密封镍镉电池可以避免KOH变质
b.镍电极为电池的负极,镉电极为电池的正极
c.电池组装后,应先充电,再使用
电池充电时,若Cd(OH)2和Ni(OH)2耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的Cd(OH)2可对电池进行过度充电保护,该方法称为镉氧循环法。
Cd(OH)2耗尽后继续充电,镉电极上生成的物质为。
实验1:在25 ℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数,数据如图2所示。

①实验1中,若反应混合液的总质量为mg,依据图1数据计算,在0—6h间,v(CH3CO3H)= g/h(用含m的代数式表示)。
②综合图1、图2分析,与20 ℃相比,25 ℃时过氧乙酸产率降低的可能原因是。(写出2条)。

依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是

已知:
i.有机物可用键线式表示,如 ![]() 可表示为
可表示为 

a.A分子中所有碳原子均在同一平面 b.C的结构简式为 ![]()
c.F+F—G的副产物中有2种互为顺反异构体 d.1 mol H最多能与2 molNaOH反应
 是合成
是合成  的中间体。下图是某同学设计的合成乳酸乙酯的流程。
的中间体。下图是某同学设计的合成乳酸乙酯的流程。 
请写出M-P的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。

实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
|
编号 |
饱 和 (NH4)2Fe(SO4)2溶液 |
饱和碘水 |
石蜡油 |
操作 |
KSCN溶液 |
现象 |
|
2-1 |
1滴 |
5mL |
1mL |
不加热 |
1滴 |
无明显现象 |
|
2-2 |
1滴 |
5mL |
1mL |
加热一段时间后冷却 |
1滴 |
无明显现象 |
研究小组同学根据所查阅资料写出的Fe3+与I-反应的离子方程式为。
(资料)AgSCN为不溶于水的白色固体。

试管a的实验现象说明滤液l中含有。
|
编号 |
实验操作 |
实验现象 |
|
4 |
在试管中加入1滴0.2mol/L(NH4)2Fe(SO4)2溶液,5mL蒸馏水,1滴试剂a,一段时间后加入1滴KSCN溶液 |
溶液不变红 |
①试剂a是 。
②依据实验4,甲同学做出判断: