
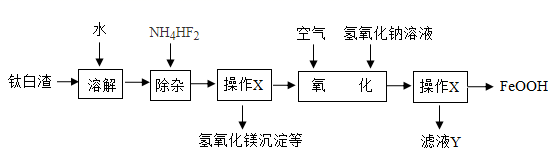
(背景信息)
a.在“溶解”时,TiOSO4跟水发生反应,生成难溶于水的H2TiO3和另一种溶于水的酸;
b.在“除杂”时,加入NH4HF2固体是为了使溶液显弱碱性,使Mg2+能与OH-结合生成沉淀,从而可除去Mg2+;
c.在“氧化”中,Fe3+与OH-也可能结合成沉淀。

①氧化时反应的温度最适宜控制在℃。
②氧化时最好控制pH在左右,pH过小或过大均会导致氧化铁黄产率偏低。请分析pH过大会导致氧化铁黄产率偏低的可能原因:。
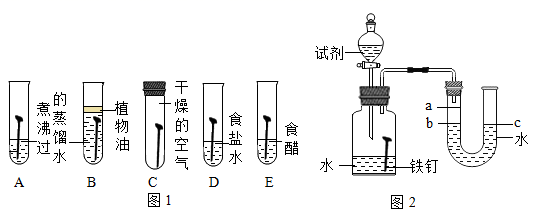
①通过观察实验A,B,C中的现象,经过科学严谨的推理得出结论:铁锈蚀是铁与发生化学反应的过程。
②实验D和E的目的是进一步探究铁在盐溶液和酸的环境中是否更容易锈蚀。铁跟醋酸(CH3COOH)反应生成醋酸亚铁[ (CH3COO)2Fe]和氢气,请写出反应的化学方程式。
(提出问题)铁锈蚀速率与哪些因素有关。
(查阅资料)氯化钠溶液能导电;乙醇溶液不能导电。
(猜想假设)铁的锈蚀速率与下列因素有关:
I.;
II.氧气的含量;
Ⅲ.水溶液的导电性。
|
影响 因素 |
实验设计 |
实验现象 |
实验结论及解释 |
|
I. |
装置甲放入25℃恒温环境中, 装置乙放入40℃恒温环境中。 |
两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,所需时间甲>乙 |
|
|
II. |
在相同温度下,向甲、乙两套装置的集气瓶中分别通入氧气和空气。 |
铁钉均锈蚀,且U型管中液面由b处上升至a处,所需时间甲乙 |
铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
|
Ⅲ. |
|
两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,所需时间甲<乙 |
铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,铁的锈蚀速率加快。 |
(反思与提高)根据该探究实验以及你所学的知识,判断下列说法正确的是(填序号)。
A.金属的腐蚀是指金属单质与其它物质发生化学反应的过程
B.金属腐蚀不一定要有氧气参加
C.金属越活泼,就越容易被锈蚀