| t/min | 0 | 3 | 6 | 10 | ……. |
| n(O2)/mol | 0.0 | 0.0008 | 0.001 | 0.0012 | ……. |
下列叙述不正确的是(溶液体积变化忽略不计)( )
①下列可作为反应达到平衡的判据是(填序号)。
A.固体的质量不再改变
B.2v正(N2)=3v逆(O 2)
C.△H 不变
D.容器内气体的压强不变
E.N2分子数与 O2 分子数比为 2:3
②在起始压强为p的反应体系中,平衡时 N2的转化率为α,则上述反应的平衡常数 Kp(对于气相反应,用某组分 B 的平衡压强 p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp , 如p(B) =p总·x(B) ,p总为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③为促进反应的进行,实际生产中需加入焦炭,其原因是。
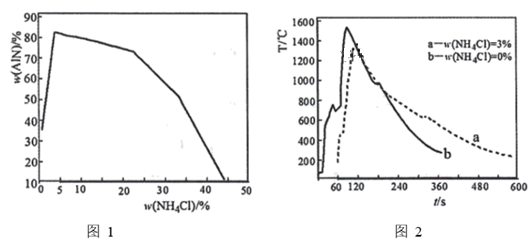
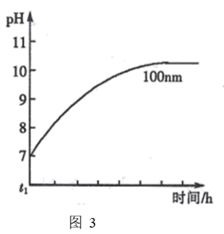
①固体混合物中,ω(NH4Cl)的最佳选择是。
②结合图2解释当ω(NH4Cl)超过一定值后,ω(AlN)明显减少的原因。
①AlN 粉末水解的化学方程式是。
②相同条件下,请在图3中画出粒径为40 nm 的AlN粉末水解的变化曲线。
CoCl2﹒6H2O 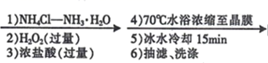 [Co(NH3)5Cl]Cl2晶体
[Co(NH3)5Cl]Cl2晶体 
已知:
a.配合物X 能溶于水,且溶解度随温度升高而增大。
b.[Co( NH3)5Cl]2+离子较稳定,但加碱再煮沸可促进其解离:[Co(NH3)5Cl]2+ Co3++5NH3+Cl。
c.H2O2参与反应时,明显放热。
请回答:
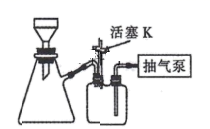
检漏→水洗→加标准液,润洗内壁→→→→→……
a.从上口倒出润洗液
b.保持滴定管夹水平,平视滴定管刻度读数
c.装标准溶液,调液面,静置半分钟
d.滴定
e.取下滴定管,竖直,平视滴定管刻度读数
f.从下口放出润洗液
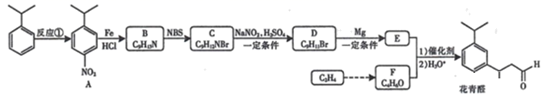
已知:(1)RX RMgX
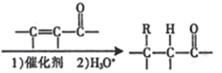 ( R 表示烃基);(2)RCHO + R'CH2CHO
( R 表示烃基);(2)RCHO + R'CH2CHO 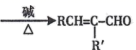 (R、R' 表示烃基或氢原子)。
(R、R' 表示烃基或氢原子)。
请回答:
①分子中共有4种氢原子,有氮氢键;
②除苯环外不含其它环状结构,且无氮氧键、碳氮双键和氧氢键。