
仪器X的名称是,其主要作用有导气、。
铜的测定:取20.00mL测液,经测定, 浓为
。则称取的样品中
mol。

①滴定时,应选用下列哪种物质作为指示剂(填标号)。
A. B.
C.
②重复实验操作三次,消耗 溶液的体积平均为10.00mL。则称取的样品中
mol。
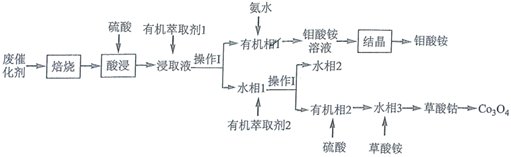
已知:浸取液中的金属离子主要为 、
、
。
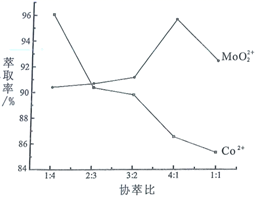
第一步:
第二步:
第三步:
第四步:
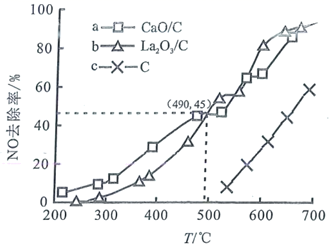
①据图分析,490℃以下,三种情况下反应的活化能最小的是(用a、b、c表示); 、
去除NO效果比C更好,其依据是(写一条)。
②上述实验中,490℃时,若测得 对NO的去除率为60%,则可能采取的措施是。
A.及时分离出 B.压缩体积
C.恒容下,向体系中通入氮气 D.寻找更好的催化剂
③490℃时的反应速率
,该温度下此反应的平衡常数为121,则反应达平衡时NO的去除率为(保留二位有效数字)。
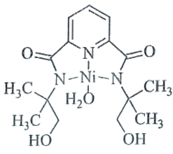
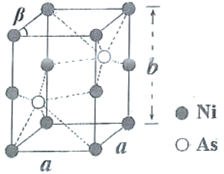
①该分子中N原子的杂化方式为、。
②请在图中用“ ”标出
的配位键。

已知:
①R-COOH+R′-NH2
+H2O;
②R-CN
![]()
回答下列问题: