①取适量A进行铝热反应,产物中有单质B生成;
②另取20g A全部溶于0.15L 6.0mol•盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色.请填空:
已知K300℃<K350℃ , 则△H0(填“>”或“<”).
元素 | 相关信息 |
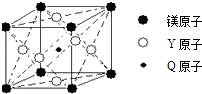
Q | Q的单质是实验室常用的惰性电极材料 |
R | R原子基态时2p原子轨道上有3个未成对电子 |
T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
X | X是第三周期电负性最大的元素 |
Y | 元素Y位于周期表第10列 |
Z | Z存在质量数为65,中子数为36的核素 |
a.Q的最简单气态氢化物比R的气体氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素形成的氢化物中最低
d.R的第一电离能、电负性都比Q大