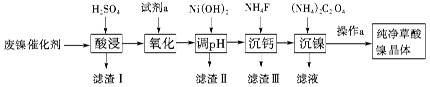
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
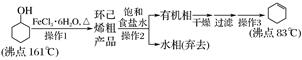
回答下列问题:
原料环己醇中若含苯酚杂质,检验试剂为,现象为。
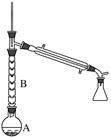
①烧瓶A中进行的可逆反应化学方程式为,
浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为(填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
②仪器B的作用为。
在一定条件下,向a g环己烯样品中加入定量制得的b mol Br2 , 与环己烯充分反应后,剩余的Br2与足量KI作用生成I2 , 用c mol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液V mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
![]()
②Br2+2KI=I2+2KBr
③I2+2Na2S2O3=2NaI+Na2S4O6
滴定所用指示剂为。样品中环己烯的质量分数为(用字母表示)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.Na2S2O3标准溶液部分被氧化
C(s)+O2(g)=CO2(g)ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g)ΔH3=-221 kJ·mol-1
若某反应的平衡常数表达式为K= ,则此反应的热化学方程式为。
|
t/min |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(N2O5)/(mol·L-1) |
1.00 |
0.71 |
0.50 |
0.35 |
0.25 |
0.17 |
①反应开始时体系压强为p0 , 第2 min时体系压强为p1 , 则p1∶p0=。2~5 min内用NO2表示的该反应的平均反应速率为。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是。(填字母)
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变

①曲线a对应的温度是。
②M点对应的H2的转化率是。

①[Cu(NH3)4]SO4中阴离子的立体构型是。
②在[Cu(NH3)4]SO4中,Cu2+与NH3 之间形成的化学键称为,提供孤电子对的成键原子是。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为。
④NF3与NH3 的立体构型相同,中心原子的轨道杂化类型均为。但NF3不易与Cu2+形成化学键,其原因是。
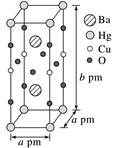
①该物质的化学式为。
②已知该晶胞中两个Ba2+的间距为c pm,则距离Ba2+最近的Hg+数目为个,二者的最短距离为pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M , 阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3。