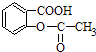 转变为
转变为 ①与足量的NaOH溶液共热,再通入CO2
②与稀硫酸共热后,加入足量的NaOH溶液
③加热溶液,通入足量的SO2
④与稀H2SO4共热后,加入足量的NaHCO3 .
相关实验 | 预期目的 | |
A | 相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 | 验证固体接触面积对化学反应速率的影响 |
B | 可逆反应FeCl3(aq)+3KSCN(aq)⇌Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 | 验证浓度对化学平衡的影响 |
C | 室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 | 验证BaSO4和BaCO3的Ksp的相对大小 |
D | 相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 | 验证不同催化剂对H2O2分解速率的影响 |
A | B | C | D | E |
①能使溴的四氯化碳溶液褪色; ②比例模型为:
③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. | ①相对分子质量比C少2; ②能由C氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为:
|
CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=﹣41kJ•mol﹣1
CaO(s)+CO2(g)⇌CaCO3(s)△H=﹣172kJ•mol﹣1
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H=﹣187kJ•mol﹣1
物质 N(mol) 时间(min) | CO2 | H2 | CaO |
0 | 0.50 | 1.00 | 0.40 |
2 | 0.35 | 0.60 | a |
6 | 0.20 | 0.20 | b |
8 | 0.20 | 0.20 | b |
①反应在0~2min内的平均反应速率v(H2)=
②b=
③反应到达平衡后,改变反应的某些条件,再次达到平衡时,不正确的是(填字母)
A.扩大容器体积c(H2)增大 B.升高温度,n(CO2)增大
C.充入少量H2 , CaCO3质量减小 D.充入少量CO2 , c(CH4)增大
④此温度下,反应CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)的化学平衡常数K=.若向10L容器中投入CO2、H2和CH4各0.1mol,H2O(g)xmol,要使v正(CO2)>v逆(CO2),x的取值范围为
Ⅰ.氨的测定:精确称取wg样品,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1mol•L﹣1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2mol•L﹣1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液.
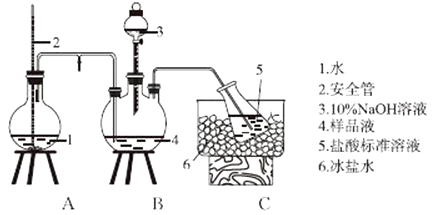
氨的测定装置(已省略加热和加持装置)
Ⅱ.氯的测定:另准确称取wg样品,配成溶液后用AgNO3标准溶液滴定.已知:AgCl为白色沉淀Ksp(AgCl)=1.8×10﹣10;Ag2CrO4为砖红色沉淀,Ksp(Ag2CrO4)=1.2×10﹣12;Ag2S为黑色沉淀,Ksp(Ag2S)=6.3×10﹣50 .
Ⅲ.根据样品质量为wg即可确定样品中Co元素的质量,进而确定样品的化学组成.
回答下列问题:
. (填“偏大”“偏小”)
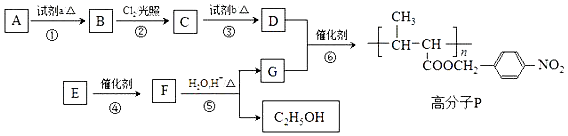
为了测定上述转化流程中有机物H的结构,做如下实验:
①将2.3g有机物H完全燃烧,生成0.1molCO2和2.7g水
②H的质谱图和核磁共振氢谱图分别为图1和图2: 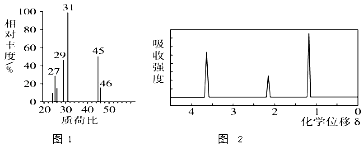
试回答下列问题:
以H为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).