甲:Cu Cu(NO3)2 乙:Cu
CuO
Cu(NO3)2
①从绿色化学的角度分析,同学的方案更合理
②乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择装置(填字母序号).
①提出假设:
假设1.黑色粉末是CuO;
假设2.黑色粉末是Fe3O4;
假设3.黑色粉末是CuO和Fe3O4的混合物.
②设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂.
a若假设1成立,则实验现象是溶液显蓝色.
b若假设2或3成立,则实验现象是.
为进一步探究,继续向所得溶液加入足量铁粉,若产生的现象,则假设3成立.
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显.
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3•H2O=Cu(NH3)42++4H2O.
为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生现象;若假设3成立,则产生现象.
尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.
①以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)⇌2NH3(g)+CO2(g)△H=+133.6kJ/mol.该反应的化学平衡常数的表达式K=.关于该反应的下列说法正确的是(填序号).
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气.
已知: 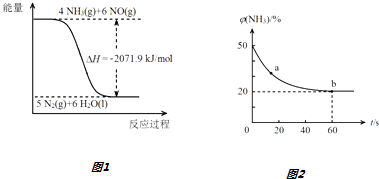
结合①中信息,尿素还原NO(g)的热化学方程式是.
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)═CO (NH2)2 (s)+H2O(g),混合气体中NH3的物质的量百分含量[φ(NH3)]随时间变化关系如图2所示
则a点的正反应速率v正(CO2)b点的逆反应速率v(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是.
硼砂(Na2B4O7▪10H2O)是硼酸的一种重要钠盐,工业上可利用碳碱法制取,以下是某化工集团利用合成氨脱碳尾气生产硼砂及其它化工产品的流程图.

回答下列问题:
①合成氨常用CH4与水蒸气反应,制取H2的同时获得脱碳尾气(上述流程图中的某物质),所发生的化学方程式为.
②轻质碳酸镁的组成可表示为xMgCO3 . yMg(OH)2 . zH2O,某小组为测定其成分,准确称取2.33g样品,充分加热后称得剩余物质质量为1.00g,所得气体经浓硫酸吸收,浓硫酸增重0.45g,则该轻质碳酸镁的化学式为:.
③结合②中的结论,推测该工厂生产硼砂溶液的化学方程式为:.
④a处的操作为:.
⑤该工艺可实现多种产品的联产,其中属于联产产品的是.
a.轻质碳酸镁 b.轻质氧化镁 c.液态二氧化碳 d.纯碱.
PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、 ![]() (PAN)等二次污染物.
(PAN)等二次污染物.
①1mol PAN中含有的σ键数目为.PAN中四种元素的第一电离能由大到小的顺序为.
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4 , 该配合物中中心离子的配位数为,中心离子的核外电子排布式为.
③相同压强下,HCOOH的沸点比CH3OCH3(填“高”或“低”),其原因是.
①(NH4)2SO4晶体中各种微粒间的作用力不涉及(填序号).
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的空间构型为,阴离子的中心原子轨道采用杂化.
测定大气中PM2.5的浓度方法之一是β﹣射线吸收法,β﹣射线放射源可用85Kr.已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则 =(填数字).
