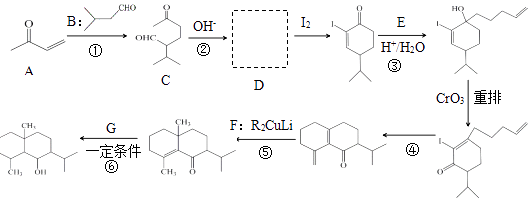
已知:
i.RCHO+R′﹣CH2﹣CHO
![]() +H2O
+H2O
ii.RMgX+ ![]() →
→ 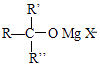
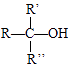
iii. 
回答下列问题:
a.能发生银镜反应b.结构为六元环状c.环上有3种氢原子
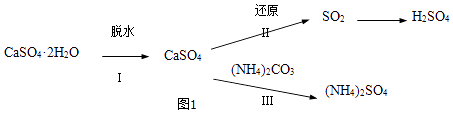
CaSO4•2H2O(s)=CaSO4• H2O(s)+
H2O(g)△H1=+83.2KJ•mol﹣1
CaSO4•2H2O(s)=CaSO4(s)+2H2O(l)△H2=+26KJ•mol﹣1
H2O(g)=H2O(l)△H3=﹣44KJ•mol﹣1
则反应CaSO4• H2O(s)=CaSO4(s)+
H2O(g)的△H4=KJ•mol﹣1 .
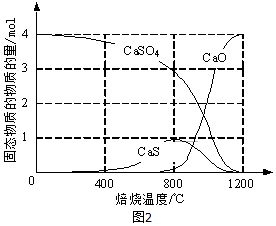
①CO作还原剂,改变反应温度可得到不同的产物.不同温度下所得固体成分的物质的量如图2所示.在低于800℃时还原产物为;1200℃时主要发生的反应的化学方程式为.
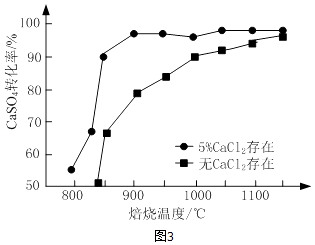
②高硫煤作还原剂,焙烧2.5小时,测不同温度下硫酸钙的转化率,如图3所示.CaCl2的作用是;当温度高于1200℃时,无论有无CaCl2 , CaSO4的转化率趋于相同,其原因是.
③以SO2为原料,工业生产硫酸的化学方程式.
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1:
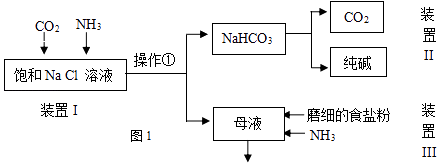
已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20℃,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
②从平衡移动角度解释该反应发生的原因.
③操作①的名称是.
a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4 , 干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
实验中所用的草酸为稀溶液,可视为强酸.
2MnO4﹣+C2O42﹣+=2 Mn2++CO2↑+H2O
H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
一般来说,其他条件相同时,增大反应物浓度,反应速率.
但分析实验数据,得到的结论是.
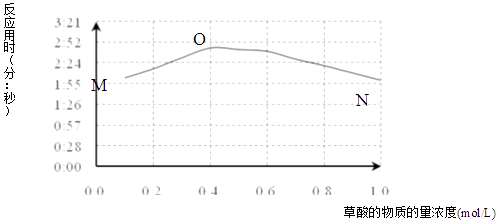
①用文字描述曲线图表达的信息.
②该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是.
a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II).(括号中罗马数字表示锰的化合价) |
b | 草酸根易与不同价态锰离子形成较稳定的配位化合物. |
c | 草酸稳定性较差,加热至185℃可分解. |
H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 0.1mol/L | 1.9×10﹣3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
1mL 0.5mol/L | 1.5×10﹣3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
1mL 1.0mol/L | 1.0×10﹣3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
该小组进行实验III的目的是.