下列各组物质:①Cu和HNO3溶液 ②Cu和FeCl3溶液 ③Zn与H2SO4溶液 ④Fe和HCl
溶液由于浓度不同而能发生不同氧化还原反应的是( )
 B .
B . 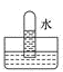 C .
C . 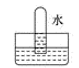 D .
D . 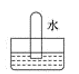
①碱液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反应原理如下:
NO + NO2 + Na2CO3 = 2NaNO2 + CO2;2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反应原理是:NOx + NH3 N2 + H2O
现将标准状况下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反应完全,且测得反应后溶液中n(NO2-)∶n(NO3-) = 4∶1,下列说法正确的是( )

①1.2 mL ②2.4 mL ③3 mL ④4 mL
A
D
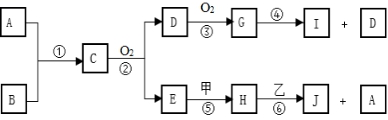
E( 在“
”之间的空白处填写装置编号)。
能证明PH3分解的气体产物的现象是。
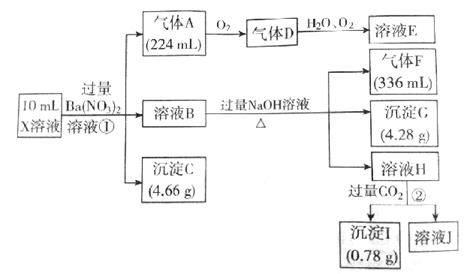
C(Fe3+)=(若填不含,则不需要计算)mol/L,X溶液中 C(Cl-)=mol/L
NO+NO2+2OH−=2 +H2O
2NO2+2OH−= +
+H2O
①下列措施能提高尾气中NO和NO2去除率的有(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是(填化学式);吸收后排放的尾气中含量较高的氮氧化物是(填化学式)。
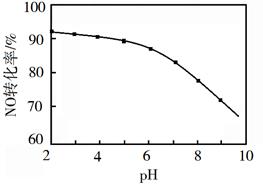
①在酸性NaClO溶液中,HClO氧化NO生成Cl−和 ,其离子方程式为。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是。
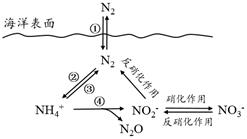
a. 海洋中存在游离态的氮
b. 海洋中的氮循环起始于氮的氧化
c. 海洋中的反硝化作用一定有氧气的参与
d. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
|
温度/℃ |
样本氨氮含量/mg[ |
处理24h |
处理48h |
|
氨氮含量/mg |
氨氮含量/mg |
||
|
20 |
1008 |
838 |
788 |
|
25 |
1008 |
757 |
468 |
|
30 |
1008 |
798 |
600 |
|
40 |
1008 |
977 |
910 |
硝化细菌去除氨氮的最佳反应温度是,在最佳反应温度时,48 h内去除氨氮反应的平均速率是mg·L-1·h-1。
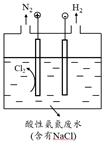
①阳极的电极反应式:;
②写出电解产物氧化去除氨氮的离子方程式:;
③若生成H2和N2的物质的量之比为3:1,则处理后废水的c(H+)将(填“增大”、“不变”或“减小”)。
![]()

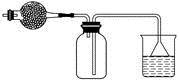
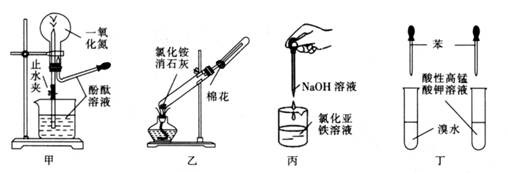
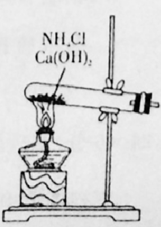
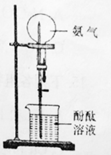
①验证A是否已经收集满的方法是(任写一种)。
②若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为L。
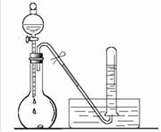
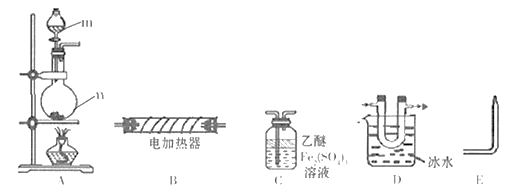
③试写出C与水反应的化学方程式,反应可得到酸X。如下图:足量X的浓溶液与Cu反应,写出烧瓶中发生反应的离子方程式。实验完毕后,试管中收集到的气体的主要成分为(写化学式)