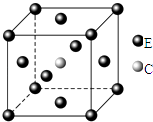
试回答下列问题:
第一步:2NH3(I)+CO2(g)⇌H2NCOONH4(I)(氨基甲酸铵)△H1
第二步:H2NCOONH4(I)⇌H2O(I)+H2NCONH2(I)△H2
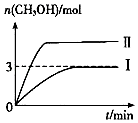
某实验小组模拟工业上合成尿素的条件,在一体积为0.2L的密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图甲所示:
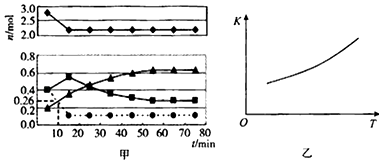
①●●代表的物质为(填化学式)
②已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第步反应决定,反应进行到10min时到达平衡.反应进行到10min时测得●●所代表的物质的量如图所示,则该物质表示的表示化学反应的速率为 mol•L﹣1•min.L﹣1
③第二步反应的平衡常数K2随温度的变化如乙图所示,则△H1 0 (填“>”“<”或“=”).
④第一步反应在 (填“较高”或“较低”)温度下有利该反应自发进行.
N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol﹣1
N2(g)+3H2(g)=2NH3(g)△H=﹣92.4kJ•mol﹣1
2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ•mol﹣1
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=.
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
CO | H2O | CO2 | |||
1 | 500 | 8 | 4 | 3.2 | 4 |
2 | 700 | 4 | 2 | 0.8 | 3 |
3 | 700 | 4 | 2 | 0.8 | 1 |
A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
②实验2中,反应达到平衡状态时,CO的转化率为.
③实验3和实验2相比,改变的条件是.
②欲使0.1mol的Na2S溶液中, 的值增大,可采取的措施是(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
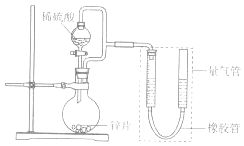
序号 | V(H2SO4)/mL | C(H2SO4)/mol•L﹣1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
①比较实验I和Ⅱ可以得出的实验结论是.
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是 (填序号).
A.二氧化硅 B.银 C.铜 D.石墨
①圆底烧瓶中的试剂可选用(填序号)
A.稀HCl B.NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是.
①基态E原子的价电子排布图为.
②E(CO)5常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5晶体属于(填晶体类型),该晶体中E的化合价为.