试剂:4% H2O2溶液,12% H2O2溶液,1mol/LFeCl3溶液
仪器:试管、带刻度的胶头滴管、酒精灯
组别 | 实验温度 (℃) | H2O2溶液 | FeCl3溶液 (1mol/L) |
1 | 30 | 5mL 4% | 1mL |
2 | 60 | 5mL 4% | 1mL |
3 | 30 | 5mL 12% | |
4 | 30 | 5mL 4% |
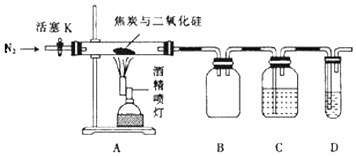
已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2O═CO2+2HCl+Pd↓(产生黑色金属钯粉末,使溶液变浑浊).
①点燃酒精喷灯
②检查装置的气密性
③通入N2一段时间
④向A的硬质玻璃管中装入焦炭(过量)与二氧化硅混合物共m g则正确的操作顺序是.