化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
能量/kJ | 535 | 472 | 496 |
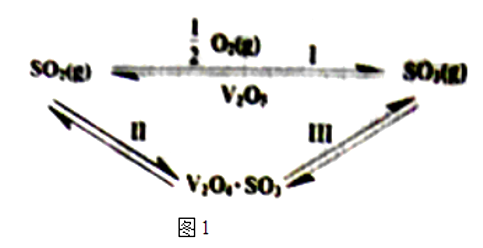
则反应I的△H=kJ/mol.反应Ⅲ的化学方程式为.
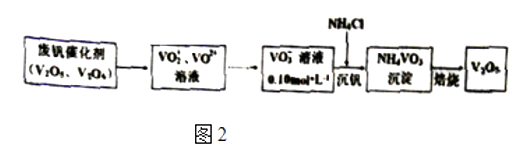
①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式.
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为[25℃,Ksp(NH4VO3)=1.6×10﹣3 , 溶液体积变化忽略不计].
①向此溶液稀溶液中再加入少量(NH4)2SO4固体, 将(填“变大”、“不变”或“变小”).
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则 =(用含a的代数式表示,NH3•H2O的Kb=1.7×10﹣5)

已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
表二
实验序号 | SO2浓度(g•m﹣3) | 烟气流速(mL•min﹣1) |
① | 4.1 | 55 |
② | 4.1 | 96 |
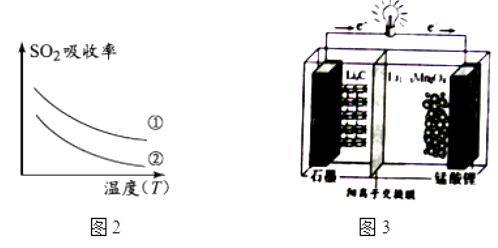
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.
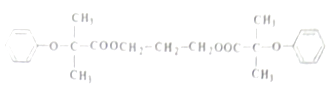
该物质的合成线路如图:
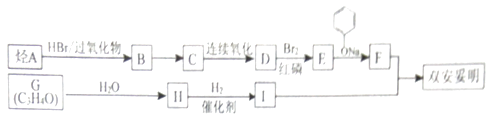
已知:I.RCH2COOH
![]()
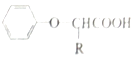
II.RCH═CH2 RCH2CH2Br
III.同温同压下A的密度是H2密度的28倍,且支链有一个甲基;G能发生银镜反应,且1molG能与2molH2发生加成反应.
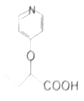 的路线:.
的路线:.