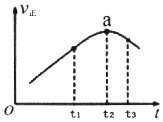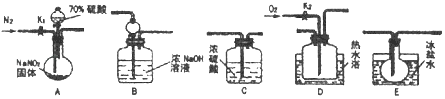
回答下列问题:
I.氧化铁是重要工业颜料,用废铁屑制备它的流程如图:
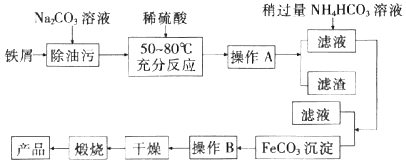
回答下列问题:
a.称取样品8.00g,加入足量稀H2SO4溶解,并加水稀杯至100mL;
b.量取25.00mL待测溶液于锥形瓶中;
c.用酸化的0.01000mol•L﹣1KMnO4标准液滴定至终点;
d.重复操作b、c2~3次,得出消耗KMnO4溶液体积的平均值为20.00mL.
写出滴定过程中发生反应的离子方程式:.
a.未干燥锥形瓶 b.盛装标准液的滴定管没有用标准液润洗
c.滴定结束时仰视刻度线读数 d.量取待测液的滴定管没有润洗.
反应II:2NO(g)+O2(g)⇌2NO2(g),△H=﹣113.0KJ•mol﹣1
则SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热反应方程式为.
②若在两个相同绝热恒容密闭容器中分别加入A:2molSO2(g)和1molO2(g);B:2molSO3(g),其它条件相同,发生反应I,达到平衡时,则该反应的平衡常数:AB(填“>”、“=”、“<”).