H2O中心原子的杂化方式为杂化,分子的立体构型为。
BF3分子中,中心原子的杂化方式为杂化,分子的立体构型为。
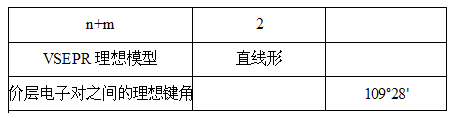
Ⅰ、用AXnEm表示只含一个中心原子的分子,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数.分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力的主要顺序为:
i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;
ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
iii、X原子得电子能力越弱,A﹣X形成的共用电子对之间的斥力越强;
iv、其他.
请仔细阅读上述材料,回答下列问题: