|
金属硫化物 |
FeS |
PbS |
CuS |
HgS |
|
Ksp |
6.3×10-18 |
1.0×10-28 |
6.3×10-36 |
1.6×10-52 |
①向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是。
②用Na2S溶液沉淀废水中Pb2+ , 为使Pb2+沉淀完全[c(Pb2+)≤1×10-6mol/L],则应满足溶液中c(S2-)≥mol/L。
③反应Cu2+(aq)+FeS(s) Fe2+(aq)+CuS(s)的平衡常数K=。
步骤1.准确称取一定量样品于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容。
步骤2.准确移取25.00mL上述溶液于锥形瓶中,加入茜素黄GG-百时香酚蓝混合指示剂,用0.2500mol/L盐酸标准溶液滴定(Na2S+HCl=NaHS+NaCl)至终点,消耗盐酸24.00mL;向其中再加入5mL中性甲醛(NaHS+HCHO+H2O→NaOH+HSCH2OH)和3滴酚酞指示剂,继续用0.2500mol/L盐酸标准溶液滴定(NaOH+HCl=NaCl+H2O)至终点,又消耗盐酸34.00mL。
计算原混合物中Na2S与NaHS的物质的量之比(写出计算过程)。
①已知下列热化学方程式:CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206kJ/mol,CO2(g)+4H2(g)
CH4(g)+2H2O(g) △H 2=-165kJ/mol,
则反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的△H=kJ/mol。
②最近我国学者采用电催化方法用CO2重整CH4制取合成气,装置如图所示。装置工作时,阳极的电极反应式为。

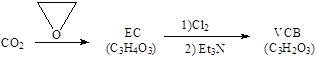
VCB的结构简式为。
(I)乙烷直接热解脱氢:C2H6(g) C2H4(g)+H2(g) △H1
(Ⅱ)CO2氧化乙烷脱氢:C2H6(g)+CO2(g) C2H4(g)+CO(g)+H2O(g) △H2
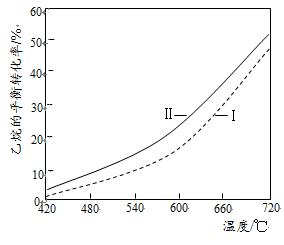
①反应(I)的△H1= kJ/mol(填数值,相关键能数据如下表)。
| 化学键 | C-C | C=C | C-H | H-H |
| 键能/kJ·mol-1 | 347.7 | 615 | 413.4 | 436.0 |
②反应(Ⅱ)乙烷平衡转化率比反应(I)的大,其原因是(从平衡移动角度说明)。
③有学者研究纳米Cr2O3催化CO2氧化乙烷脱氢,通过XPS测定催化剂表面仅存在Cr6+和Cr3+ , 从而说明催化反应历程为:C2H6(g)→C2H4(g)+H2(g),和(用方程式表示,不必注明反应条件)。
④在三个容积相同的恒容密闭容器中,温度及起始时投料如下表所示,三个容器均只发生反应:C2H6(g) C2H4(g)+H2(g)。温度及投料方式(如下表所示),测得反应的相关数据如下:
| 容器1 | 容器2 | 容器3 | |
| 反应温度T/K | 600 | 600 | 500 |
| 反应物投入量 | 1molC2H6 | 2molC2H4+2molH2 | 1molC2H6 |
| 平衡时v正(C2H4)/ mol/(L·s) | v1 | v2 | v3 |
| 平衡时c(C2H4)/ mol/L | c1 | c2 | c3 |
| 平衡常数K | K1 | K2 | K3 |
下列说法正确的是(填标号)。
A.K1=K2 , v1<v2
B.K1<K3 , v1< v3
C.v2>v3 , c2>2c3
D.c2+c3<3c1
②碱性条件水解生成两种产物,酸化后分子中均只有4种不同化学环境的氢,其中之一能与FeCl3溶液发生显色反应。
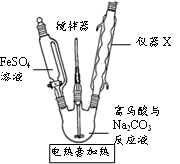
步骤1.称取4.0g碎铁屑,放入烧杯中,加入10%Na2CO3溶液,煮沸、水洗至中性。
步骤2.向清洗后的碎铁屑中加入3mol/L H2SO4溶液20mL,盖上表面皿,放在水浴中加热。不时向烧杯中滴加少量蒸馏水,控制溶液的pH不大于1。
步骤3.待反应速度明显减慢后,趁热过滤得FeSO4溶液。
①步骤1的实验目的是。
②步骤2“不时向烧杯中滴加少量蒸馏水”的目的是;“控制溶液的pH不大于1”的目的是。
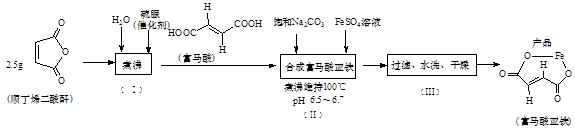
①步骤(Ⅰ)所得产品(富马酸)为-丁烯二酸(填“顺”或“反”)。
②富马酸与足量Na2CO3溶液反应的方程式为。
③图中仪器X的名称是,使用该仪器的目的是。
①(NH4)2Ce(SO4)3标准溶液适宜盛放在(填“酸式”或“碱式”)滴定管中。
②该实验中能否用KMnO4标准溶液代替(NH4)2Ce(SO4)3标准溶液滴定Fe2+ , 说明理由。
③产品中铁的质量分数为(用含a、V的代数式表示)。