①C(s)+H2O(g)═CO(g)+H2 (g) △H1=a kJ•mol﹣1
②CO(g)+H2O(g)═CO2(g)+H2 (g) △H2=b kJ•mol﹣1
③CO2 (g)+3H2 (g)═CH3OH(g)+H2O(g) △H3=c kJ•mol﹣1
④2CH3OH(g)═CH3OCH3 (g)+H2O(g) △H4=d kJ•mol﹣1
容器编号 | 物质的起始浓度(mol•L﹣1) | 物质的平衡浓度(mol•L﹣1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
(12分)铝是应用广泛的金属.以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
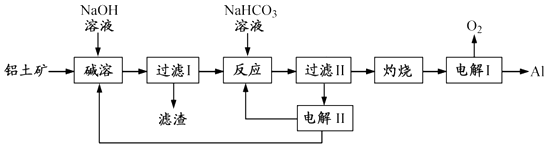
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀.
“电解Ⅱ”是电解Na2CO3溶液,原理如图所示.

阳极的电极反应式为,阴极产生的物质A的化学式为.
(15分)化合物H是一种用于合成γ﹣分泌调节剂的药物中间体,其合成路线流程图如下:
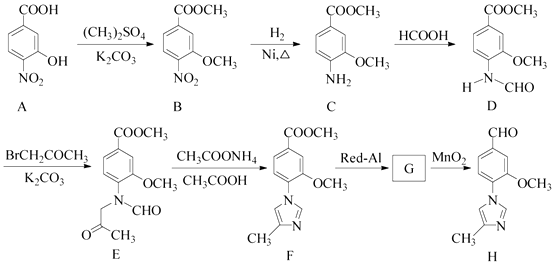
①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α﹣氨基酸,另一水解产物分子中只有2种不同化学环境的氢.
已知: 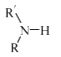
 (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以 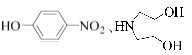 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备 ![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
碱式氯化铜有多种制备方法
①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2•3H2O,该反应的化学方程式为.
②方法2:先制得CuCl2 , 再与石灰乳反应生成碱式氯化铜.Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2 , Fe3+对该反应有催化作用,其催化原理如图所示. M′的化学式为.

①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl 0.1722g;
③另取25.00mL溶液A,调节pH 4~5,用浓度为0.08000mol•L﹣1的EDTA(Na2H2Y•2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++H2Y2﹣═CuY2﹣+2H+),滴定至终点,消耗标准溶液30.00mL.通过计算确定该样品的化学式(写出计算过程).
(15分)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含 量过低,对实验的影响可忽略).
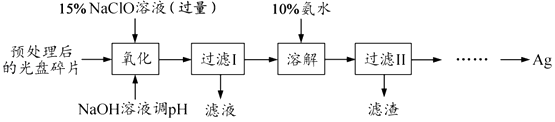
已知:①NaClO溶液在受热或酸性条件下易分解,如 3NaClO═2NaCl+NaClO3
②AgCl可溶于氨水 AgCl+2NH3•H2O⇌Ag(NH3)2++Cl﹣+2H2O
③常温时 N2H4•H2O(水合肼)在碱性条件下能还原 Ag(NH3)2+:
4Ag(NH3)2++N2H4•H2O═4Ag↓+N2↑+4NH4++4NH3↑+H2O
H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图﹣1和图﹣2所示.
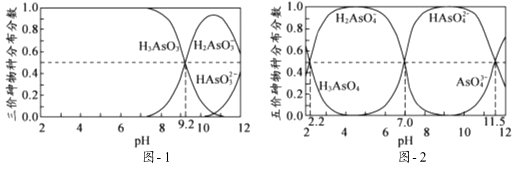
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加.该过程中主要反应的离子方程式为.
②H3AsO4第一步电离方程式H3AsO4⇌H2AsO4﹣+H+的电离常数为Ka1 , 则pKa1=
(p Ka1=﹣lg Ka1 ).
溶液的pH对吸附剂X表面所带电荷有影响.pH=7.1时,吸附剂X表面不带电荷; pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多.pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图﹣3所示.

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是.
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为. 提高吸附剂X对三价砷去除效果可采取的措施是.
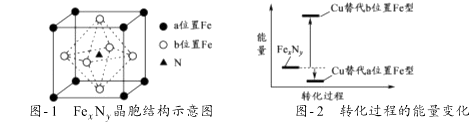
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景.某FexNy的制备需铁、氮气、丙酮和乙醇参与.
丙酮( ![]() )分子中碳原子轨道的杂化类型是,1mol 丙酮分子中含有σ键的数目为.
)分子中碳原子轨道的杂化类型是,1mol 丙酮分子中含有σ键的数目为.
某FexNy的晶胞如图﹣1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x﹣n) CunNy . FexNy转化为两种Cu替代型产物的能量变化如图﹣2 所示,其中更稳定的Cu替代型产物的化学式为.
B . [实验化学]
1﹣溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm﹣3 . 实验室制备少量1﹣溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr.
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止.

步骤3:将馏出液转入分液漏斗,分出有机相.
步骤4:将分出的有机相转入分液漏斗,依次用12mL H2O、12mL 5% Na2CO3溶液和12mL H2O洗涤,分液,得粗产品,进一步提纯得1﹣溴丙烷.