| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/(mol·L-1) | 0.10 | 0.20 | 0.20 |
| c(SO2)/(mol·L-1) | 0.10 | 0.10 | 0.20 |
| 表述1 | 表述2 | |
| A | 向盛有硫酸铜溶液的试管里滴加氨水至过量,先形成难溶物,继而难溶物溶解得到深蓝色的透明溶液 | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的数目不变 |
| B | 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高 | 邻羟基苯甲醛形成分子内氢键,对羟基苯甲醛形成分子间氢键 |
| C | SO32-空间结构是三角锥形结构 | SO32-的中心原子S原子为sp3杂化 |
| D | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |

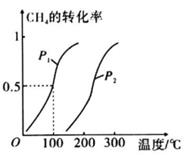
①已知压强为p1 , 100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为。
②图中的p1 p2(填“<”“>”或“=”),100℃时平衡常数为。
③在其他条件不变的情况下降低温度,重新达到平衡时H2体积分数将(填“增大”“减小”或“不变”)
①该反应的△H0,△S0(填“<”“>”或“=”)
②若容器容积不变,下列措施可提高H2转化率的是。
A.升高温度
B.将CH3OH(g)从体系中分离
C.再充入2 molCO和2molH2
D.充入He,使体系总压强增大
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1=akJ·mol-1
②PbS(s)2PbO(s)=3Pb(s)+SO2(g) △H2=b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H3=c kJ·mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s) △H=kJ·mol-1(用含a、b、c的代数式表示)

①“酸溶”时,在Fe2+催化下,Pb和PbO2反应成1 mol PbSO4时转移电子的物质的量为 mol。
②已知:PbO溶解在NaOH溶液中,存在化学平衡:PbO(s)+NaOH(aq) NaHPbO2(aq),其溶解度曲线如图1所示:
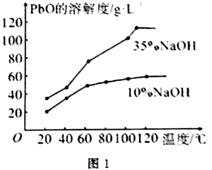
结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,(填 “趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
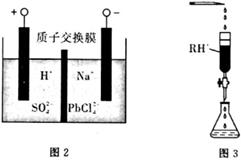
①阴极的电极反应式为;
②当有4.14gPb生成时,通过质子交换膜的n(H+)=。
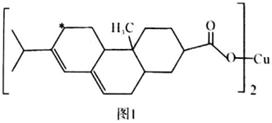
松脂酸铜结构中π键的个数为;加“*”碳原子的杂化方式为。