一、<b >选择题</b>
-
1.
化学与日常生活密切相关,下列说法错误的是( )
A . 碘酒是指单质碘的乙醇溶液
B . 84消毒液的有效成分是NaClO
C . 浓硫酸可刻蚀石英制艺术品
D . 装饰材料释放的甲醛会造成污染
-
2.
下列有关物质性质的说法错误的是( )
A . 热稳定性:HCl>HI
B . 原子半径:Na>Mg
C . 酸性:H2SO3>H2SO4
D . 结合质子能力:S2﹣>Cl﹣
-
3.
以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉).下列说法错误的是( )
A . 阴极附近溶液呈红色
B . 阴极逸出气体
C . 阳极附近溶液呈蓝色
D . 溶液的pH变小
-
4.
标准状态下,气态分子断开1mol化学键的焓变为键焓.已知H﹣H,H﹣O和O=O键的键焓△H分别为436kJ•mol﹣1、463kJ•mol﹣1和495kJ•mol﹣1 . 下列热化学方程式正确的是( )
A . H2O(g)═H2(g)+  O2(g)△H=﹣485kJ•mol﹣1
B . H2O(g)═H2(g)+
O2(g)△H=﹣485kJ•mol﹣1
B . H2O(g)═H2(g)+  O2(g)△H=+485kJ•mol﹣1
C . 2H2(g)+O2(g)═2H2O(g)△H=+485kJ•mol﹣1
D . 2H2(g)+O2(g)═2H2O(g)△H=﹣485kJ•mol﹣1
O2(g)△H=+485kJ•mol﹣1
C . 2H2(g)+O2(g)═2H2O(g)△H=+485kJ•mol﹣1
D . 2H2(g)+O2(g)═2H2O(g)△H=﹣485kJ•mol﹣1
-
5.
下列除杂操作可行的是( )
A . 通过浓硫酸除去HCl中的H2O
B . 通过灼热的CuO除去H2中的CO
C . 通过灼热的镁粉除去N2中的O2
D . 通过水除去CO中的CO2
-
6.
NaOH溶液滴定盐酸实验中,不必用到的是( )
A . 酚酞
B . 圆底烧杯
C . 锥形瓶
D . 碱式滴定管
二、<b >选择题</b>
-
7.
下列有关物质水解的说法正确的是( )
A . 蛋白质水解的最终产物是多肽
B . 淀粉水解的最终产物是葡萄糖
C . 纤维素不能水解成葡萄糖
D . 油脂水解产物之一是甘油
-
8.
某反应过程能量变化如图所示,下列说法正确的是( )
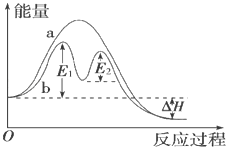
A . 反应过程a有催化剂参与
B . 该反应为放热反应,热效应等于△H
C . 改变催化剂,不能改变该反应的活化能
D . 有催化剂条件下,反应的活化能等于E1+E2
-
9.
下列关于物质应用的说法错误的是( )
A . 玻璃容器可长期盛放各种酸
B . 纯碱可用于清洗油污
C . 浓氨水可检验氯气管道漏气
D . Na2S可除去污水中的Cu2+
-
10.
下列关于物质应用和组成的说法正确的是( )
A . P2O5可用于干燥Cl2和NH3
B . “可燃冰”主要成分是甲烷和水
C . CCl4可用于鉴别溴水和碘水
D . Si和SiO2都用于制造光导纤维
-
11.
室温下,用0.100mol•L
﹣1 NaOH溶液分别滴定20.00mL 0.100mol•L
﹣1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
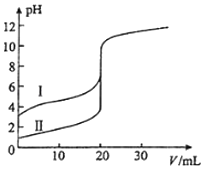
A . Ⅱ表示的是滴定醋酸的曲线
B . pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C . V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
D . V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
-
12.
将BaO2放入密闭的真空容器中,反应2BaO2(s)⇌2BaO(s)+O2(g)达到平衡.保持温度不变,缩小容器体积,体系重新达到平衡,下列说法正确的是( )
A . 平衡常数减小
B . BaO量不变
C . 氧气压强不变
D . BaO2量增加
三、<b >解答题</b>
-
13.
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题:

-
(1)
元素x在周期表中的位置是第周期,第族,其单质可采用电解熔融的方法制备.
-
(2)
m、n、y三种元素最高价氧化物的水化物中,酸性最强的是,碱性最强的是.(填化学式)
-
(3)
气体分子(mn)2的电子式为.(mn)2成为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为.
-
14.
硝基苯甲酸乙酯在OH
﹣存在下发生水解反应:
O2NC6H4COOC2H5+OH﹣⇌O2NC6H4COO﹣+C2H5OH
两种反应物的初始浓度均为0.050mol•L﹣1 , 15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示.回答下列问题:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
-
(1)
列示计算该反应在120~180s与180~240s区间的平均反应速率、;比较两者大小可得出的结论是.
-
-
(3)
为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有(要求写出两条).
-
15.
卤代烃在生产生活中具有广泛的应用,回答下列问题:
-
(1)
多卤代甲烷常作为有机溶剂,其中分子结构为正四面体的是.工业上分离这些多氯代甲烷的方法是.
-
(2)
三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式(不考虑立体异构).
-
(3)
聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下:
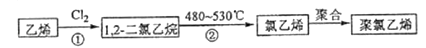
反应①的化学方程式为,反应类型为;反应②的反应类型为.
-
16.
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO
4溶于混合有机溶剂中,Li
+通过电解质迁移入MnO
2晶格中,生成LiMnO
2 . 回答下列问题:

-
-
-
(3)
是否可用水代替电池中的混合有机溶剂?(填“是”或“否”),原因是.
-
(4)
MnO2可与KOH和KClO3在高温下反应,生成K2MnO4 , 反应的化学方程式为.K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为.
-
17.
硫代硫酸钠(Na
2S
2O
3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na
2S+Na
2CO
3+4SO
2═3Na
2S
2O
3+CO
2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:

-
-
(2)
反应开始后,c中先有浑浊产生,后又变澄清.此浑浊物是.
-
-
(4)
试验中要控制SO2生成速率,可以采取的措施有(写出两条).
-
(5)
为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是.
四、<b >选做题,请考生在选修</b><b>5</b><b >、选修</b><b >3</b><b>、选修</b><b>2</b><b >三题中任选一题作答,多做则按所做的第一题计分选修</b><b>5-</b><b >有机化学基础</b>
-
18.
图示为一种天然产物,具有一定的除草功效.下列有关该化合物的说法错误的是( )
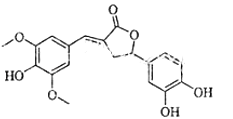
A . 分子含有三种含氧官能团
B . 1mol该化合物最多能与6mol NaOH反应
C . 既可以发生取代反应,又能够发生加成反应
D . 既能与FeCl3发生显色反应,也能与NaHCO3反应放出CO2
-
19.
1,6﹣已二酸(G)是合成尼龙的主要原料之一,可用含六个碳原子的有机化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F):

回答下列问题:
-
(1)
化合物A中含碳87.8%,其余为氢,A的化学名称为.
-
-
-
(4)
在上述中间物质中,核磁共振氢谱出峰最多的是,最少的是.(填化合物代号)
-
-
(6)
由A通过两步反应制备1,3﹣环已二烯的合成路线为.
五、<b >选修</b><b>3-</b><b >物质的结构与性质</b>
-
20.
对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是( )
A . SiX4难水解
B . SiX4是共价化合物
C . NaX易水解
D . NaX的熔点一般高于SiX4
-
21.
碳元素的单质有多种形式,如图依次是C
60、石墨和金刚石的结构图:
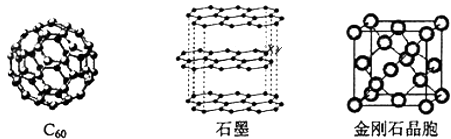
回答下列问题:
-
(1)
金刚石、石墨、C60、碳纳米管都是碳元素的单质形式,它们互为.
-
(2)
金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为、.
-
-
(4)
石墨晶体中,层内C﹣C键的键长为142pm,而金刚石中C﹣C键的键长为154pm.其原因是金刚石中只存在C﹣C间的共价键,而石墨层内的C﹣C间不仅存在共价键,还有键.
-
(5)
金刚石晶胞含有个碳原子.若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=a,列式表示碳原子在晶胞中的空间占有率(不要求计算结果).
六、<b >选修</b><b>2-</b><b >化学</b>
-
22.
下列有关叙述正确的是( )
A . 碱性锌锰电池中,MnO2是催化剂
B . 银锌纽扣电池工作时,Ag2O被还原为Ag
C . 放电时,铅酸蓄电池中硫酸浓度不断增大
D . 电镀时,待镀的金属制品表面发生还原反应
-
23.
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌.某含锌矿的主要成分是ZnS(还含有少量FeS等其它成分),以其为原料炼锌的工艺流程如图所示:

回答下列问题:
-
(1)
硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为.
-
(2)
焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的操作.
-
(3)
浸出液“净化”过程中加入的主要物质为,其作用是.
-
(4)
电解沉积过程中的阴极采用铝板,阳极采用Pb﹣Ag合金惰性电极,阳极逸出的气体是.
-
(5)
改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种由工业价值的非金属单质,“氧压酸浸”中发生主要反应的离子方程式为.
-
(6)
我国古代曾采用“火法”工艺冶炼锌.明代宋应星著《天工开物》中有关“升炼倭铅”的记载:“炉甘石十斤,装载入一尼罐内,…,然后逐层用煤炭饼垫盛,其底铺薪,发火锻红,…,冷淀,毁罐取出,…即倭铅也.”该炼锌工艺主要反应的化学方程式为.(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌).

