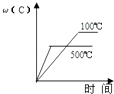
 B .
B . 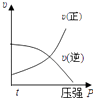 C .
C . 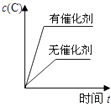 D .
D . 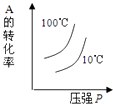
实验用品 | 溶液温度 | 中和热 | ||
t1 | t2 | △H | ||
① | 50 mL0.55 mol•L﹣1NaOH溶液 | 20℃ | 23.3℃ | |
50 mL0.5 mol•L﹣1HCl溶液 | ||||
② | 50 mL0.55 mol•L﹣1NaOH溶液 | 20℃ | 23.5℃ | |
50 mL0.5 mol•L﹣1HCl溶液 | ||||
已知:Q=cm(t2﹣t1),反应后溶液的比热容c为4.18J•℃﹣1•g﹣1 , 各物质的密度均为1g•cm﹣3 .
①计算完成上表△H=(保留2位小数).
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:.
实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800℃ | 1.0 | 0.8 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据表中数据完成下列填空: