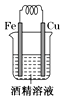
 B .
B . 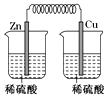 C .
C . 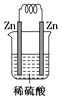 D .
D . 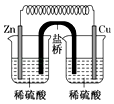

|
实验编号 |
待测HCl溶液的体积/mL |
滴入NaOH溶液的体积/mL |
|
1 |
20.00 |
23.00 |
|
2 |
20.00 |
23.10 |
|
3 |
20.00 |
22.90 |
该实验中用去标准液的体积为mL。
若用酚酞作指示剂,则判断达到滴定终点时的现象是。