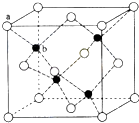
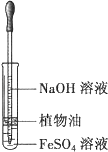
 观察Fe(OH)2的生成
B .
观察Fe(OH)2的生成
B . 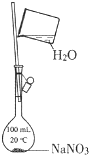 配制一定物质的量浓度的NaNO3溶液
C .
配制一定物质的量浓度的NaNO3溶液
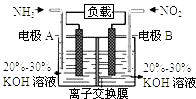
C . 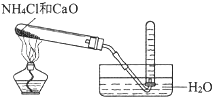 实验室制取氨
D .
实验室制取氨
D . 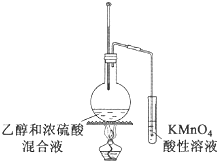 验证乙烯的生成
验证乙烯的生成
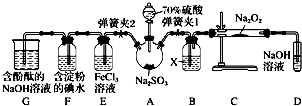
取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应.上述方案是否合理?(填“合理”或“不合理”),原因是.
一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g)⇌CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是(填序号).
A.每消耗1mol CO的同时生成2molH2B.混合气体总物质的量不变
C.CH3OH、CO、H2的浓度都不再发生变化D.生成CH3OH的速率与消耗CO的速率相等
②CO的平衡转化率(α)与温度、压强的关系如图所示.A、B两点的平衡常数K(A) K(B)(填“>”、“=”或“<”).
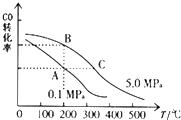
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率=,此温度下的平衡常数K=(保留两位有效数字).