实验序号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
下列说法正确的是( )
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸.
①新制氯水久置后→浅黄绿色消失
②Cl2通入石蕊试液中→先变红后褪色
③SO2通入石蕊试液中→先变红后褪色
④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色.

①开始反应的化学方程式为.
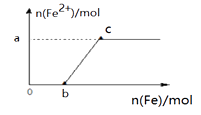
②若铜有剩余,则反应将要结束时的反应的离子方程是:
③待反应停止后,再加入少量的25%的稀硫酸,这时铜片上又有气泡产生,其原因是.
请回答下列问题:

②假设只生成NO2 , 通过计算理论上收集到的气体体积为mL (标准状况下).
③实验最终测得气体的体积为130.5mL(标准状况下),与理论值有差异,其理由可能为.
A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO
B.过程中还发生了反应4NO+3O2+2H2O=4HNO3
C.过程中还发生了反应4NO2+O2+2H2O=4HNO3
D.硝酸具有挥发性,对实验有影响.
A:,D:.
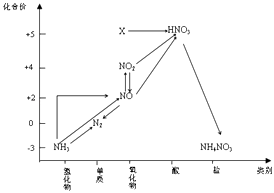
写出D→B的化学方程式:


【资料卡片】
i.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
ii.在230℃以上时,同时有弱光:2NH4NO3═2N2↑+O2↑+4H2O
iii.在400℃以上时,剧烈分解发生爆炸:4NH4NO3═3N2↑+2NO2+8↑H2O