弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25℃) | 1.8×10﹣5 | 4.9×10﹣10 | K1=4.3×10﹣7 K2=5.6×10﹣11 |
则下列有关说法正确的是( )
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
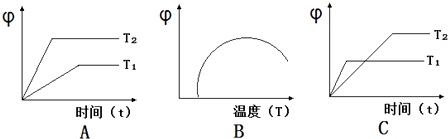
如图图象符合反应①的是(填序号)(图中φ是混合物中CO的含量;T为温度).
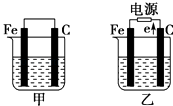
①甲中石墨棒上的电极反应式是.
②将湿润的淀粉KI试纸放在乙烧杯的上方,发现试纸先变蓝后褪色,这是因为电解生成的某种气体A氧化了I﹣生成了I2 . 若A气体和I2按物质的量之比为5:1反应,且生成两种酸,该反应的化学方程式为.
③如果不考虑气体产物与烧杯中溶液之间的反应,当乙反应有0.01mol电子转移后停止实验,烧杯中溶液的体积为100mL,则溶液混匀后的pH=
①甲中铁棒上的电极反应式为.
②乙中总反应的离子方程式为.
③如果起始时乙中盛放100mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入(填写物质的化学式) g.

①B中可通过判断可逆反应2NO2⇌N2O4已经达到平衡.
②若平衡后在A容器中再充入0.5mol N2O4 , 则重新到达平衡后,平衡混合气中NO2的体积分数(填“变大”“变小”或“不变”).
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于
④若打开K2 , 平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为 L.
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |