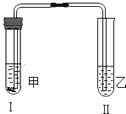
按如图所示装置进行实验(图中铁架台等仪器均已略去).先在试管Ⅱ中加入试剂乙,然后在试管Ⅰ中加入试剂甲,立即塞紧橡皮塞,一段时间后,观察到试管Ⅱ中有白色沉淀生成.符合以上实验现象的一组试剂是( )
【猜想与假设】碳酸钾溶液的酸碱度可能有种情况
实验一:向盛有适量碳酸钾溶液的试管中滴加几滴紫色石蕊试液,溶液变为蓝色.
实验二:向盛有适量碳酸钾溶液的试管中滴加几滴无色酚酞试液,溶液变为红色.
实验三:取pH试纸于玻璃片上,用玻璃棒蘸取碳酸钾溶液滴在pH试纸上,测得pH=12.
【结论】以上实验证明碳酸钾溶液呈性,从物质的分类看,碳酸钾属于类(填”酸”“碱”“盐”),从而说明此类物质的水溶液不一定显中性.
①用托盘天平称取样品w克放入烧杯中加水溶解;
②加入足量BaCl2溶液充分反应.证明反应后BaCl2剩余的方法是;
③过滤、洗涤、干燥、称量沉淀的质量为mg;
④样品中碳酸钠的质量分数为.
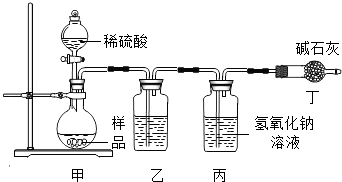
①实验装置乙中盛放的试剂为,装置丁的作用是.
②学习小组通过测量丙装置实验前后的质量.确定二氧化碳的质量.实验中滴加稀硫酸的速度过快,产生的气流过急.会导致测得样品中碳酸钠的质量分数(填写“偏高”“偏低”或“不变”).
称取一定质量的样品放入烧杯中加水溶解:;
过滤、洗涤、干燥、称量沉淀的质量;计算出氯化钠的质量,再得样品中碳酸钠的质量分数.
【实验1】取该混合液50 g ,向其中逐滴加入稀盐酸,当加入稀盐酸的质量为20 g、40 g、60 g 时,生成气体的质量见下表(气体的溶解度忽略不计)。
【实验2】另取该溶液50 g ,加入一定量稀盐酸充分反应后,测得溶液的pH=7,然后再加入硝酸银溶液,测得实验数据见右图。

试分析计算: