
已知:Ba(NO3)2的溶解度受温度影响较大。
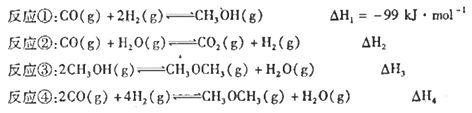
CO(g)和H2(g)以物质的量之比1:2混合,一定条件下在1L固定容积内发生反应①,下图表示温度分别为300℃、500℃的密闭容器中,甲醇的物质的量与时间的关系。回答下列问题:
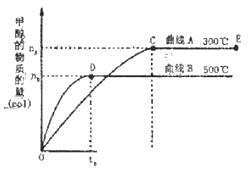
①C、D两点平衡常数KC KD(填>、<、= )。
②在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2下列有关该体系的说法正确的是 。
a. 正反应速率加快,逆反应速率也加快
b.甲醇的物质的量增加
c.重新平衡时n(H2)/n(CH3OH)增大

①甲容器中,反应在t1min内的平均速率v(H2)= mol/(L•min)。
②乙容器中,a=mol。
③解释降低温度使CO2平衡浓度增大的原因。