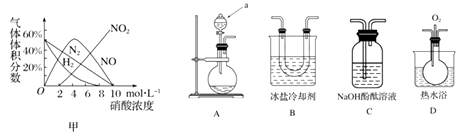
[查阅资料]
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图甲所示
b.NO2沸点:21 ℃;NO沸点:-151 ℃
c.2NO2+2OH-=NO-+NO2-+H2O,NO+NO2+2OH-=2NO2-+H2O
a仪器的名称是。
1 | 2 | 3 | 4 | |
KMnO4(mL) | 20.01 | 19.00 | 19.99 | 20.00 |
Na2SO3 (mL) | 25.00 | 25.00 | 25.00 | 25.00 |
求样品中Na2SO3的质量分数。
已知:CH4(g)+CO2(g)= 2CO(g)+2H2(g) ΔH=+247.3 kJ·mol-1
CH4(g)=C(s)+2H2(g) ΔH=+75 kJ·mol-1
①反应2CO(g)=C(s)+CO2(g) ΔH= kJ·mol-1。
②合成甲醇的主要反应:2H2(g)+CO(g) CH3OH(g) ΔH=-90.8 kJ·mol-1 , T ℃时此反应的平衡常数为160。此温度下,在密闭容器中开始只充入CO、H2 , 反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/mol·L-1 | 0.20 | 0.10 | 0.40 |
比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)。
③在一固定容积的密闭容器中发生反应2H2(g)+CO(g) CH3OH(g),若要提高CO的转化率,则可以采取的措施是(填字母)。
a.升温 b.加催化剂 c.增加CO的浓度 d.加入H2加压e.加惰性气体f.分离出甲醇

①A极为电池的极,B电极的反应式为。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L-1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为(标况下)。
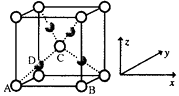
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)C为( ,
,
)。则D原子的坐标参数为它代表原子。
②若Cu2O晶胞的棱长是a cm, 阿伏加德罗常数值为NA , 求该晶体的密度。